企业进行一致性评价资质的认定,大体可以通过两种途径:正常程序申报以及制剂出口转报国内。
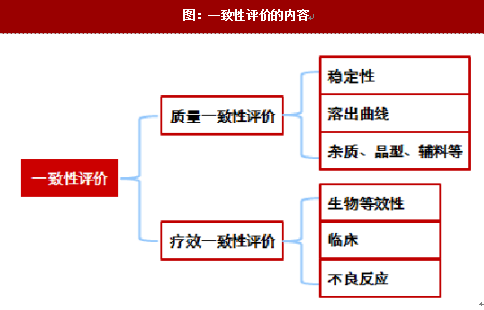
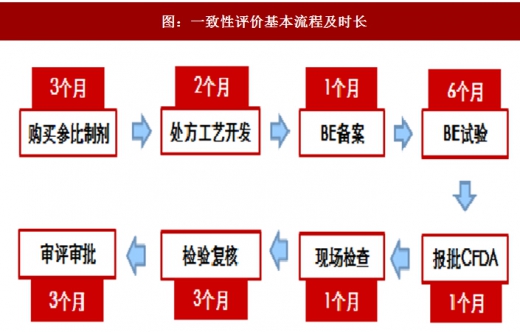
正常程序申报一致性评价需进行质量一致性及疗效一致性的研究。从参比制剂的购买、处方工艺的开发、BE到审评审批等,整个一致性评价的周期约为20个月,且花费不菲。
参考观研天下发布《2018-2024年中国新型制剂行业市场需求现状分析及未来发展方向研究报告》
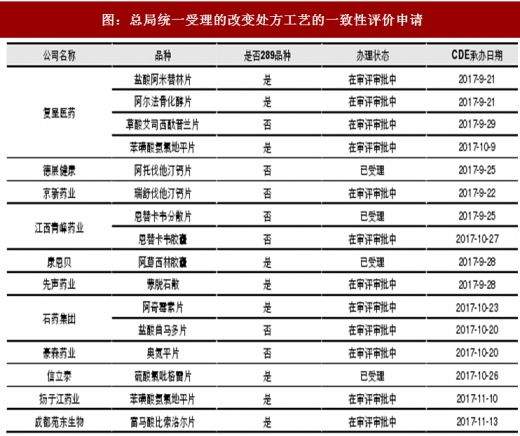
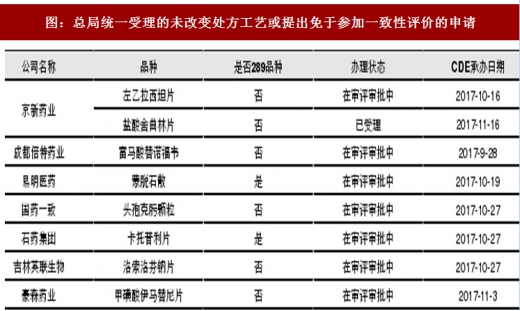
从药监总局目前披露的数据来看,已经有较多企业尤其是上市公司的一致性评价申请获得CDE受理。
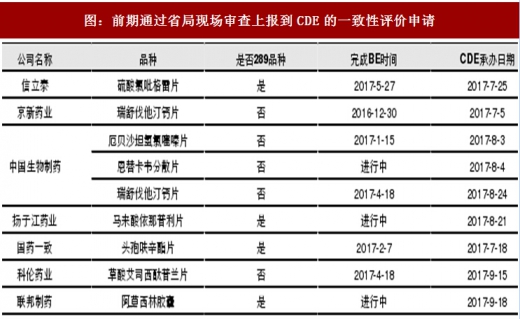
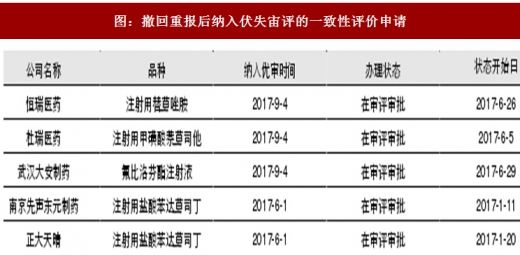
在一致性评价主线上,我们认为制剂出口转报国内品种特别值得关注。相对而言,这类品种具有以下优势,业绩兑现能力和弹性也相对较大:
可以直接享受一致性评价待遇:根据《总局关于仿制药质量和疗效一致性评价工作有关事项的公告》,“在欧盟、美国或日本批准上市的仿制药已在中国上市并采用同一生产线同一处方工艺生产的,申请人需提交境外上市申报的生物等效性研究、药学研究数据等技术资料,由国家食品药品监督管理总局审评通过后,视同通过一致性评价。”
相对较好的定价能力。在目前招标制度下,一般新的省份招标会参考之前省份的最低价。制剂出口新的回归品种,由于没有历史中标价的限制,往往能够在现阶段贴近原研定价。价格优势,也将为公司抢占市场份额提供极大的便利。
享受欧美规范市场增量。制剂出口型产品,除能够享受到国内一致性评价的红利外,海外市场本身的业务弹性也值得重视。随着部分国内上市公司的制剂出口能力日渐提升,我们认为未来几年中国企业在欧美市场也可能有大品种出现。
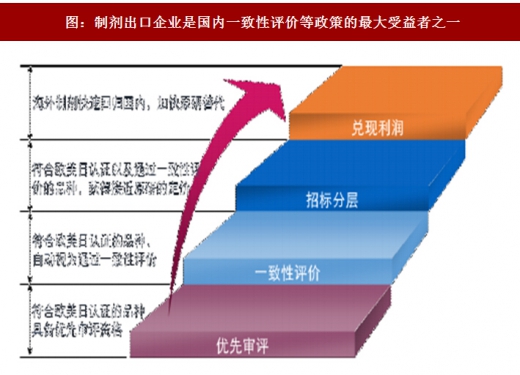
在一致性评价领域,我们重点看好华海药业、普利制药等制剂出口型的高品质仿制药企业,同时建议关注其他进展较快的国内申报企业。

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。









